Antikorlar, spesifik antijenleri hedefleme yetenekleri sayesinde günümüzün en yaygın tedavi sınıfı haline gelmiştir. Bu özellikleri, kanserden otoimmün hastalıklara kadar birçok rahatsızlığı tedavi etme imkanı sunmaktadır. Antikorların yüksek spesifikliği, off-target etkilerin olasılığını azaltır ve bu da onları karmaşık durumlar için küçük moleküllü ilaçlara göre daha güvenli ve etkili hale getirir.
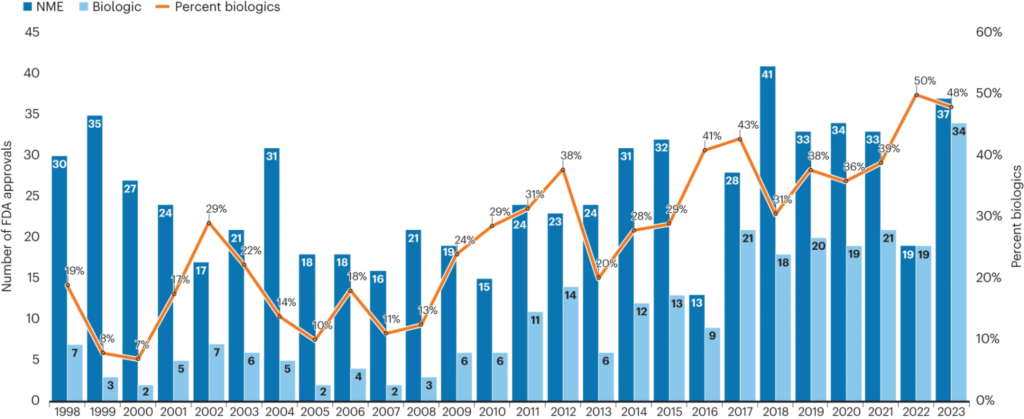
Bunun sonucunda, monoklonal antikorlar (mAbs) biyolojik ilaç onaylarında ön planda yer almaktadır. ABD Gıda ve İlaç Dairesi (FDA) verileri bu eğilimi doğrulamaktadır. 2018 ile 2023 yılları arasında ajans, her yıl yaklaşık 30 mAb onaylamış ve antikor bazlı tedaviler, yeni biyolojik ilaç onaylarının yaklaşık %50’sini temsil etmiştir (Şekil 1). Bu artış, biyofarma endüstrisindeki genel bir kaymayı da yansıtmaktadır.
Antikor Modelleme Zorlukları
Her ne kadar antikorlar yaygınlık kazansa da, antikorların protein yapısı tahmin modelleri kullanılarak modellenmesi zordur. Antikorlar, farklı hedefleri tanıyıp bağlanabilmek için yüksek derecede değişken bölgeler olan tamamlayıcılık belirleyici bölgeleri (CDR) ile inşa edilmiştir. Bu CDR’ler, antikorların sayısız patojene yanıt vermesine olanak tanırken, yapısal çeşitlilikleri mevcut modellerle doğru bir şekilde tahmin edilmelerini zorlaştırmaktadır.
Gelişimde çığır açan bir model olan AlphaFold, genellikle stabilize ve korunmuş yapılar için optimize edilmiştir. Oysa antikorlar son derece esnektir ve CDR’leri, spesifik hedefe bağlı olarak şekil ve bağlanma yönünde kaymalar gösterir. Bu esneklik onların işlevselliği için hayati önem taşırken, yapısal tahminleri karmaşık hale getirir.
Araştırmalar, antikor modellerinin biyolojik davranışlarını doğru bir şekilde yansıtmak için bir dizi olası konformasyonu yakalaması gerektiğini göstermektedir. Tek bir yapıdan ziyade, bu çeşitlilik esastır.
A-Alpha Bio’nun Çözümleri
A-Alpha Bio, Seattle merkezli bir biyoteknoloji şirketidir ve AlphaBind: Antikor-Antijen Bağlanma Affinitesini Tahmin ve Optimize Etmek için Alan Spesifik Model adlı bir çalışmayı NVIDIA çözümleri ekibi ile birlikte yayınlamıştır. Bu çalışma, antikor-antijen bağlanma affinitesinin yüksek performansla tahmin ve optimizasyonunu sağlayan bir derin öğrenme modeli olan AlphaBind’ın geliştirilmesini anlatmaktadır.
Veri Üretimi ve Model Eğitimi
AlphaBind, yüksek verimli deneysel verilerle makine öğrenim tekniklerini birleştirerek modelini eğitmiştir. A-Alpha’nın AlphaSeq platformu kullanılarak büyük ölçekli affinite veri setleri üzerinde maya display kütüphaneleri ve yeni nesil dizileme yapılarak veri üretimi gerçekleştirilmiştir. Bu süreç, antikor-antijen bağlanma güçlerinin kantitatif ölçümlerini sağlamış ve model eğitimine yönelik gerekli verileri oluşturmuştur.
AlphaBind modelinin mimarisi, antikor ve hedef dizilerinin ESM-2nv embeddings’ini giriş olarak kullanmaktadır. Bu girişler, bağlanma affinitesini tahmin etmek için dört dikkat başlığı ve yedi katmandan oluşan bir transformer ağı tarafından işlenmektedir.
Model, özel verilere göre ince ayar yapılmadan önce, ilişkisiz antikor-antijen sistemlerinden yaklaşık 5 milyon satırdan oluşan AlphaSeq verisi ile önceden eğitilmiştir. Bu, modelin transfer öğrenimi kullanmasına imkan tanımıştır. Daha sonra model, optimize edilen ebeveyn antikorlara özel verilere göre ince ayar yapılmıştır.
Dizi Optimizasyonu ve Aday Seçimi
AlphaBind, antikor bağlanma affinitesini artırmak için stochastik açgözlü optimizasyon yaklaşımı kullanmaktadır. Toplamda 100 jenerasyon boyunca 60 bin optimizasyon süreci yürütülmüş, bu süreçte mutasyon önerileriyle birlikte, tahmin edilen affiniteleri artıranlar tutulmuştur.
Optimize edilen diziler, ebeveyn antikor ile edit mesafelerine göre gruplandırılmıştır; bu gruplar 2 ila 11 mutasyon içermektedir.
Geliştirme aşamasında uygulanabilirliği sağlamak amacıyla, en iyi adaylar Tedavi Antikoru Profiler (TAP) kullanılarak taranmıştır. Bu filtreleme, potansiyel geliştirilme sorunları olan dizilerin ayrılmasını sağlamıştır. Bu havuzdan, 7.5 bin aday deneysel doğrulama için seçilmiş, bu beş en iyi aday ise biyolayer interferometrisi (BLI) ile daha fazla test edilmiştir.
Deneysel Doğrulama
Seçilen 7.5 bin aday, AlphaSeq testi kullanılarak yüksek verimli affinite ölçümleri ile değerlendirilmektedir. En iyi beş aday, ebeveyn kontrolleri ile birlikte ifade edilip BLI kullanılarak affinite iyileştirmelerinin doğrulanması için test edilmiştir.
AlphaBind, NVIDIA ve AWS Teknolojisi İle Güçlendiriliyor
AlphaBind, performansını optimize etmek için NVIDIA ve AWS teknolojilerini entegre etmektedir.
NVIDIA’dan, BioNeMo çerçevesinde ESM-2nv embeddings kullanmakta ve eğitim ile çıkarım işlemlerini NVIDIA H100 GPU’ları üzerinde gerçekleştirmektedir.
Amazon EC2 üzerinde ise modelin eğitimi ve optimizasyonu için sekiz H100 GPU içeren p5.48xlarge örneklerini kullanmaktadır. NVIDIA GPU optimize edilmiş AI modellerinin BioNeMo çerçevesi ile birleşimi, AWS’nin ölçeklenebilir bulut altyapısı, AlphaBind’ın hızla eğitimi ve dağıtımını sağlar.
AlphaBind ayrıca AWS HealthOmics üzerinde bulunmaktadır. Bu, karmaşık iş akışlarının ölçeklenebilir şekilde yönetimini sağlayan bir AWS hizmetidir. AWS, diğer biyolojik keşif araştırmacılarının kolayca erişip yeniden kullanabileceği kapsamlı bir protein tasarımı örnekleri listesi yayınlamıştır: İlaç Keşif Çalışma Akışları.
Sonuçlar
AlphaBind, aşağıda belirtilen çeşitli antikor optimizasyon kampanyalarında etkileyici performans sergilemiştir:
- Her ebeveyn antikor için binlerce yüksek affinite adayı oluşturmuştur.
- BLI tarafından doğrulanan adayların %100’ü ebeveyn antikorlardan daha yüksek bağlanma gösterdi.
- Optimize edilen adaylar arasında yüksek dizi çeşitliliği sağlanarak, diğer özelliklere göre daha sonrasında seçim yapılmasına imkân tanınmıştır.
Modelin etkinliği, farklı antikor türlerinde ve alternatif ince ayar veri kaynakları kullanıldığında bile tutarlı bir şekilde gözlemlenmiştir.
Temel Model Yaratma Yöünde
Ön eğitim, AlphaBind’ın belirli veri setlerinde ince ayar yapabilme yeteneğini artırsa da, tüm bağlanma etkileşimlerine tam olarak uyum sağlayamamaktadır. Gerçekten genel bir model oluşturmak için çok daha büyük ve çeşitli veri setlerine ihtiyaç vardır.
Bu veri setlerinin daha geniş bir antikor-antijen yapı yelpazesini kapsaması ve daha fazla ön eğitim gerektirmesi de önemlidir. Gelecekte veri toplama, federasyon ve derin öğrenme alanındaki ilerlemeler, sıfır atış antikor mühendisliği gerçekleştirmek için anahtar olacaktır.
Bu yaklaşım, tedavi edici antikorların tamamen bilgisayar destekli yöntemlerle tasarlanabilmesi, deneysel çalışmalara olan ihtiyacın azalması, biyolojik geliştirme süreçlerinin hızlanması, daha uygun maliyetli hale gelmesi ve daha erişilebilir hale gelmesi için imkân tanıyacaktır.
NVIDIA’nın sürekli gelişen AI modelleri ve GPU’ları ile AWS’nin evrim geçiren bulut yetenekleri sayesinde, AlphaBind gibi modeller biyolojik keşif için optimizasyon süreçlerine devam edecektir.
Daha fazla bilgi için aşağıdaki kaynaklara göz atabilirsiniz: